北京时间2025年2月20日,西湖大学未来产业研究中心、生命科学学院、西湖实验室卢培龙课题组,在Nature杂志在线发表题为De novo design of transmembrane fluorescence-activating proteins的科研报道——他们首次实现了跨膜荧光激活蛋白的从头设计,这也是第一个通过人工设计得到的能够非共价结合特定小分子的跨膜蛋白。博士生朱璟熠、梁明福、孙科为本文共同第一作者,研究员卢培龙为通讯作者。

论文链接:
https://www.nature.com/articles/s41586-025-08598-8
顾名思义,跨膜蛋白“跨”在细胞膜上,如果将细胞膜看作城墙的话,膜蛋白就是进出城市的城门,细胞内外的物质交换、信息传递,都要通过各种各样的膜蛋白来完成。人类基因组编码的所有蛋白质中,有超过四分之一是膜蛋白。
人体的五种感觉——视觉、听觉、触觉、味觉和嗅觉——都依赖于膜蛋白的关键作用。拿视觉来说,人视网膜视锥细胞中的视紫红质(rhodopsin),是人类直接感受光信号的分子,它结合作为感光基团的视黄醛(retinal),并借助视黄醛分子光致变构的特性,对外界的光信号作出响应,从而使人类能够看见多姿多彩的大千世界。
作为细胞生命活动的核心部件,膜蛋白的功能一旦出现异常,细胞乃至整个生命体的生理活动就容易出问题,各种疾病也便随之而来。目前世界上大约一半现代药物的靶标分子都属于膜蛋白。在许多常见的心血管疾病、精神类疾病,以及更难治疗的癌症、阿尔茨海默症等疾病中,都能够找到与其密切相关的膜蛋白分子,增强或抑制这些膜蛋白的功能,很可能成为治疗疾病的关键。
“那么是否有可能通过人工设计来按需定制全新的、理想的膜蛋白呢?”
10年前,卢培龙加入了华盛顿大学蛋白质设计研究所——也就是2024年诺贝尔化学奖获得者David Baker的课题组——开启了一段长达5年的博士后研究。2018年,也就是入组的第四年,他在世界上首次实现了对多次跨膜蛋白的精确从头设计。该研究采用了多条螺旋状的结构作为蛋白骨架,与天然存在的跨膜蛋白的常见架构相符合。
这项工作标志着对膜蛋白的精确设计的起步。也因为尚在起步阶段,当时设计的膜蛋白只有结构,没有生理功能。
2019年,卢培龙回国,全职加入西湖大学生命科学学院,组建了自己的课题组——蛋白质设计实验室。2020年8月,Nature报道了由他与David Baker团队合作完成的最新研究——全球首次实现对跨膜孔蛋白的精确从头设计。
这次在Nature发表的新工作,是卢培龙在2019年回国后开展的,一作朱璟熠是2019级博士研究生。他入学的时候,实验室才刚刚“开张”,他跟着卢老师从买试剂买设备开始,想尽快把这个课题启动起来。
他们的目标,是从头设计一种能够特异性地结合某种小分子的跨膜蛋白。这好比在生物膜环境中创造了一个独特的“泊位”,只能允许特定类型的“船舶靠岸”停放。
前面提到的人类直接感受光信号的视紫红质,就是因为具有能够特异结合视黄醛分子的“泊位”,才能够发挥感光的作用。这里“特异结合”的结构,被形象地称为“结合口袋(binding pocket)”。不同膜蛋白的“结合口袋”能够根据其独特的结构,来识别、结合与之相匹配的特定配体,从而实现特定的功能。比如葡萄糖转运蛋白转运葡萄糖分子进入人体细胞,为细胞提供能量;或者NMDA受体被氯胺酮药物分子抑制,对抑郁症起到治疗的作用。
课题组计划在从头设计的蛋白内部也构建一个这样的“口袋”,来特异性地结合目标配体分子。
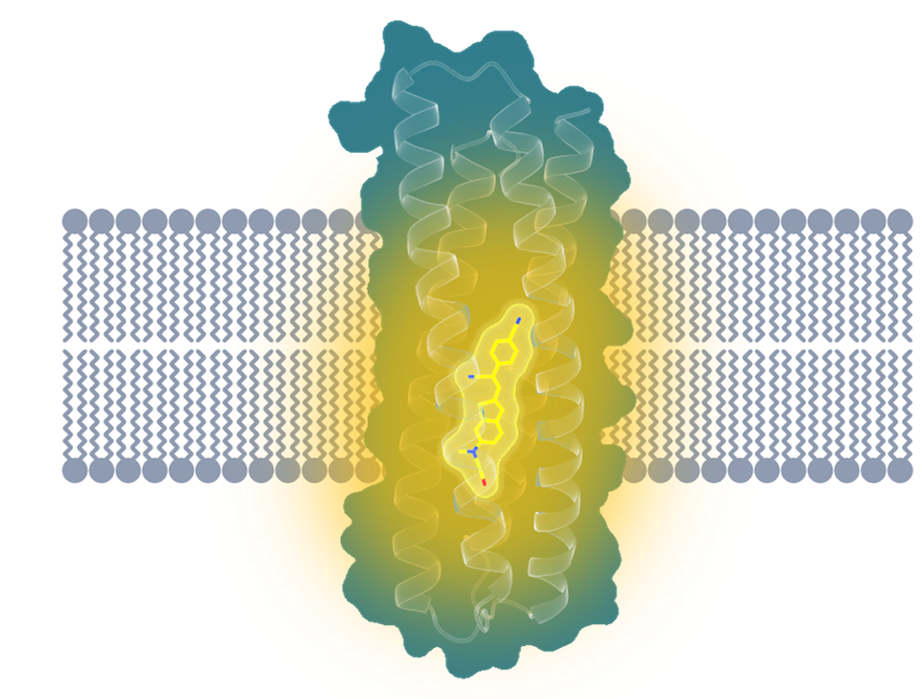
跨膜荧光激活蛋白结构示意图
作为结合目标的小分子,他们也选好了——一种名叫HBC的荧光基团。这种分子在游离状态下并不会发光,只有当以特定姿态被稳定结合,才能发出荧光。如果成功,这项技术有望广泛应用在膜成像、跨膜传感器、跨膜物质传输等领域。
选择荧光基团作为目标配体分子还有另外一个理由。在上一次设计“跨膜孔蛋白”的时候,为了验证那些离子究竟是不是从设计好的通道蛋白中透过去的,需要用复杂的测试体系才能得到强有力的证据,这一过程花费了课题组大量的时间。而如果选择会发光的分子,亮了即代表成功,一目了然。
设计过程分为两步——先设计一个水溶性、不跨膜的简易版;成功后,再将其改造成跨膜蛋白。
研究人员打磨了数不清的设计版本,终于成功构建出了这样一个“口袋”,它不仅成功地结合(点亮)了配体荧光基团HBC599,而且结合后的荧光强度是游离状态的上千倍,远超天然跨膜荧光蛋白。
再后来,研究人员们一方面稳住好不容易得来的“口袋”结构,另一方面把蛋白表面从“亲水”设计成“疏水”,最终得到了一个“跨膜”版本的荧光激活蛋白。这一次足足亮了1600倍!
2023年9月,卢培龙最后一轮修改完文章,正式向Nature投稿。龙年春节前夕,编辑发回三位匿名审稿人的意见,评价两极化非常严重。对设计的跨膜荧光蛋白进行实验结构解析,为这个课题保留了一线生机,但也仅仅只有“一线”而已。冷静下来后,卢培龙也认可这个审稿意见。“此前确实有很多人尝试设计膜蛋白,也不乏一些有意思的结果,但最大的问题在于它们很难形成稳定的三维结构,缺乏结构上的验证,又或者很难做到实验中获得的结构与设计模型一致。”
“不管是结构生物学,还是蛋白质设计,我都是在全世界最强的实验室里学的。”卢培龙在这样的打气中觅得了解题思路,“我们的跨膜荧光蛋白太小了,可以用蛋白质设计的方法把它变大呀!”
2024年9月,距离上一次投稿正好一年。课题组成功解析出设计蛋白与荧光基团复合物的高分辨率冷冻电镜结构,证实其与设计模型高度一致。修改完善后的文章,终于得到了三位审稿人的正面意见。
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 中国教育在线
中国教育在线



