近日,杭州师范大学基础医学院郭瑞庭教授团队联合中国科学院天津工业生物技术研究所高书山研究员团队,采用单颗粒冷冻电镜技术在麦角生物碱生物合成关键酶EasC研究上取得新突破。该研究相关成果以“Chanoclavine synthase operates by an NADPH independent superoxide mechanism"为题3月6日在国际顶级期刊Nature(《自然》)上在线发表。
郭瑞庭教授与高书山研究员为论文的共同通讯作者。杭州师范大学为论文的第一单位,中科院微生物所、湖北大学、荷兰代尔夫特理工大学、中国科学技术大学、中国海洋大学为论文合作单位。这是学校首篇作为第一完成单位在Nature上发表的论文,实现了重大突破。
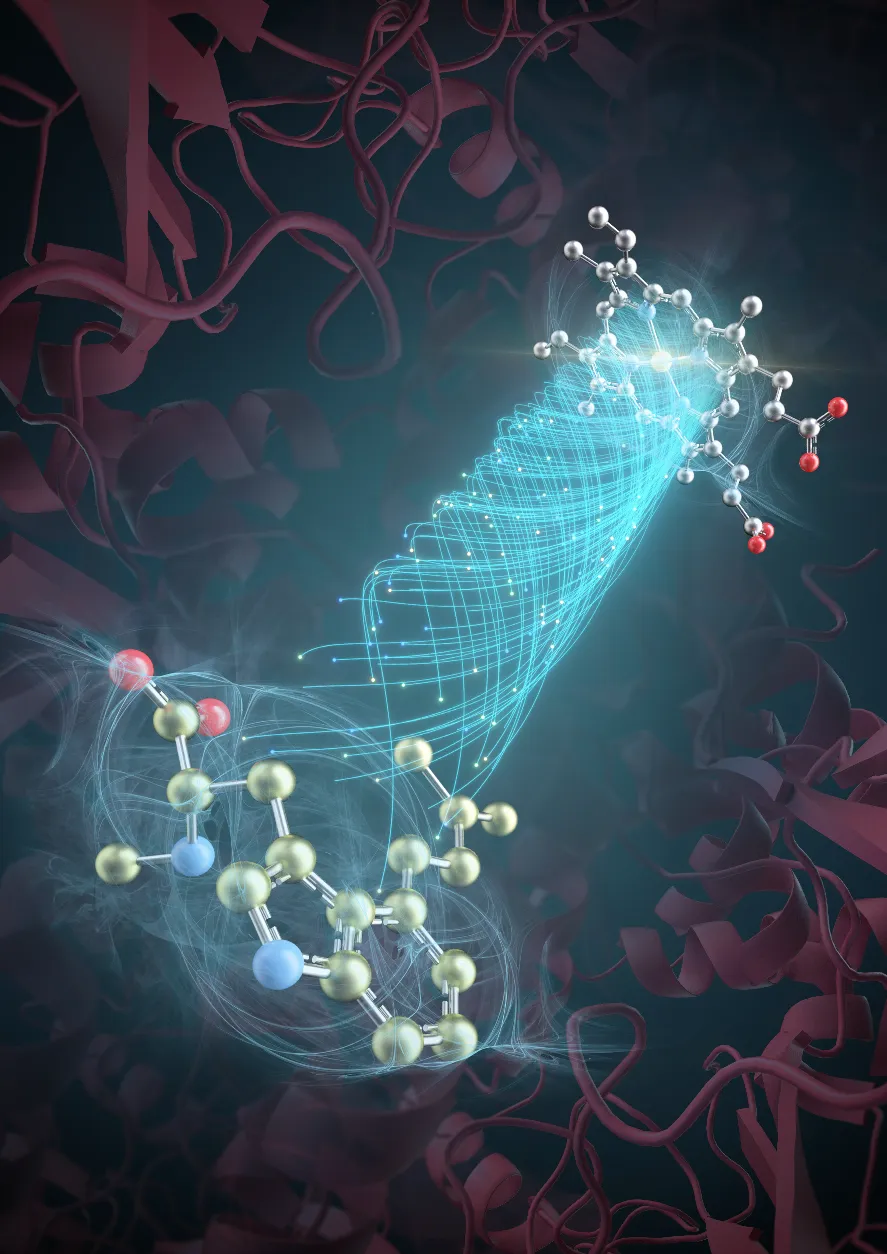
近年来,麦角生物碱类化合物的微生物合成体系构建与优化成为各国科学家研究的焦点。研究表明,过氧化氢酶EasC是麦角生物碱生物合成关键酶。但由于麦角生物碱生物合成关键酶EasC的结构信息缺失,造成底物结合模式与酶催化机制长期以来处于黑箱之中,科学家们无法得知真正的催化机制,更无法进一步进行酶的改造。
郭瑞庭教授团队与高书山研究员团队合作,就这一悬而未决的科学问题开展了研究。郭瑞庭教授团队利用单颗粒冷冻电镜解析了麦角生物碱合成酶EasC与底物的单颗粒冷冻电镜结构,发现麦角生物碱底物结合区独立于血红素结合区之外,单独存在于另一个区域中,完全颠覆了以往已知类型由血红素和底物直接结合并催化的酶反应机制。
研究团队结合生物化学、同位素化学以及波谱学实验,发现了一种全新的、不依赖辅酶-氧的非典型氧气激活途径。该途径产生的超氧阴离子可以进一步通过超氧阴离子传递通道输送至麦角生物碱底物反应位点,催化一连串复杂的环化反应以生成麦角生物碱。
据研究团队介绍,在以往的研究中,不同模式的氧气激活途径及其生物合成参与机制鲜见报道。学术界广泛采用的典型氧气激活途径为酶结构中的有机分子或金属离子等辅酶与氧气结合,形成辅酶-氧激活复合体;辅酶-氧激活复合体进一步来催化底物的氧化/加氧等生物化学反应。
本研究展示了一种全新的氧气激活途径,即将氧气转化为超氧阴离子的非典型机制;该氧气激活途径通过产生超氧阴离子,而非典型激活途径的辅酶-氧复合物,参与微生物药物的生物合成,拓展了关于氧气参与微生物合成代谢的机制和作用的研究,为深入理解微生物在不同环境条件下的代谢过程提供了新的视角和理论基础。同时,本研究也让过氧化氢酶的相关研究从H2O2依赖性酶转向O2依赖性酶,拓展了过氧化氢酶这一氧化酶的研究领域。
“该研究成果不仅是基础医学院坚持有组织科研,打破界限、协同创新取得的成果,也为学校推进‘双一流’建设注入了强大动力,为地方经济社会发展提供了有力支撑。”学校科研处负责人李勇进教授表示,将不断加大支持力度,为科研人员坐住坐稳“冷板凳”、敢于善于“攀顶峰”做好服务,推动形成更多“能上书架”“摆上货架”的重大原始创新成果。
近年来,学校紧密围绕市委市政府《关于进一步支持杭州师范大学争创国家“双一流”建设高校的若干意见》,聚焦“顶天”“立地”,对标“六个一流”,统筹推进教育科技人才一体化发展。通过实施“登峰工程”,开展有组织科研,推进以教育学、分子手性与生物医药交叉学科为重点的学科群建设,推动不同学科间的深度交叉融合,为重大原始创新成果的产生提供土壤,并设立“交叉学科团队建设工程”专项资金,鼓励学科交叉融合与标志性成果产出。
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 中国教育在线
中国教育在线



